Ученые из Института теоретической и экспериментальной биофизики РАН (ИТЭБ РАН) и Института Белка РАН в соавторстве с зарубежными коллегами из Болгарии и Франции изучили атомную структуру мутантной формы уникального белка – никующей эндонуклеазы (никазы). Результаты их исследований опубликованы в июньском номере JOURNAL OF STRUCTURAL BIOLOGY.
Никазы – это ферменты, используемые в генной инженерии в качестве так называемых «молекулярных ножниц». Они распознают в ДНК короткую специфическую последовательность, но вносят разрыв в строго определенном месте только в одну из цепей ДНК, в отличие от своих функционально родственных эндонуклеаз, вносящих разрыв в обе цепимолекулы ДНК. К настоящему времени ученые разработали множествометодов, использующих никазы. Например, очень перспективно применение таких ферментов для повышения точности редактирования генома в качестве потенциальных терапевтических агентов. Поэтому исследования этой, до сегодняшнего времени, небольшой группы ферментов, представляют серьезный интерес.
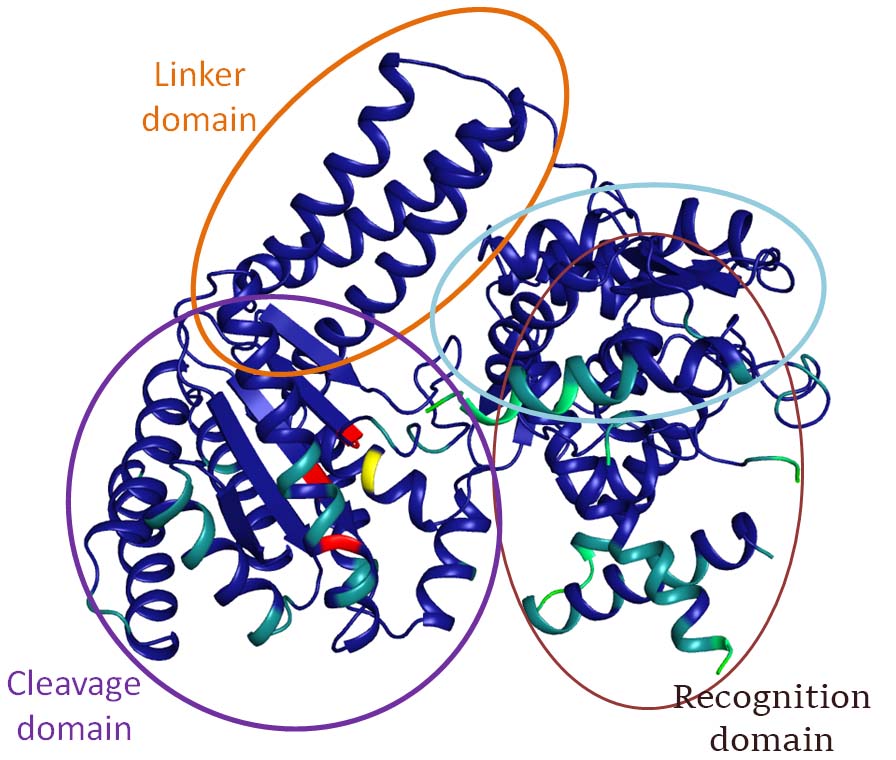
Группа исследователей из ИТЭБ РАН под руководством д.б.н. Л.А.Железной одними из первых обнаружила никующую эндонуклеазу BspD6I, и первыми расшифровали ее пространственную структуру. Было установлено, что молекула фермента имеет доменную структуру и состоит из узнающего и каталитического доменов, соединенных между собой линкерным доменом.
Функцию белковой молекулы определяет ее активный центр – уникальная комбинация аминокислотных остатков в молекуле фермента с определенной ориентацией относительно друг друга. Для того, чтобы исследователи могли контролировать активность белка, важно знать роль отдельных аминокислот, входящих в активный центр фермента.
Исследователи из ИТЭБ РАН в молекуле никазы с помощью сайт-направленного мутагенеза заменили остаток глутаминовой кислоты E418 на аланин. Далее ими была получена высокоочищенная мутантная форма никазы, из которой был выращен белковый монокристалл. Методом рентгеноструктурного анализа была решена атомная структура молекулы мутантной никазы с разрешением 2.45 Å.
Сопоставление функции дикой и мутантной форм никазы показало, что изменение всего одной аминокислоты в структуре привело к серьезнейшим последствиям: резко снизилась способность фермента к связыванию с ДНК, и произошла полная потеря каталитической активности мутантного белка. Необходимо было найти объяснение причин, вызвавших изменение функциональных свойств мутантной никазы.
Старший научный сотрудник лаборатории клеточной инженерии ИТЭБ РАН, к.х.н. Римма Ивановна Артюх отмечает, рассказывая о результатах работы: «Сравнительный анализ кристаллических структур дикой и мутантной никаз показал, что удаление карбоксильной группы в Е418 инициирует заметные конформационные изменения, как в узнающем домене, отвечающем за связывание с ДНК, так и в каталитическом и незначительные - в линкерном домене. Сравнение электростатических потенциалов атомов аминокислотных остатков в активных центрах мутантной и дикой никаз показало заметные изменения электростатического поля в активном центре дикой никазы». Таким образом, увеличение доли отрицательных потенциалов в активном центре является барьером для взаимодействия никазы с отрицательно заряженной молекулой ДНК и приводит к потере способности фермента расщеплять цепь ДНК.
Источник: Artyukh, RI; Kachalova, GS; Yunusova, AK; Fatkhullin, BF; Atanasov, BP; Perevyazova, TA; Popov, AN; Gabdulkhakov, AG; Zheleznaya, LA. The key role of E418 carboxyl group in the formation of Nt.BspD6I nickase active site: Structural and functional properties of Nt.BspD6I E418A mutant. JOURNAL OF STRUCTURAL BIOLOGY, Том: 210 Выпуск: 3, DOI: 10.1016/j.jsb.2020.107508
http://apps.webofknowledge.com/full_record.do?product=WOS&search_mode=Ge
Никазы – это ферменты, используемые в генной инженерии в качестве так называемых «молекулярных ножниц». Они распознают в ДНК короткую специфическую последовательность, но вносят разрыв в строго определенном месте только в одну из цепей ДНК, в отличие от своих функционально родственных эндонуклеаз, вносящих разрыв в обе цепимолекулы ДНК. К настоящему времени ученые разработали множествометодов, использующих никазы. Например, очень перспективно применение таких ферментов для повышения точности редактирования генома в качестве потенциальных терапевтических агентов. Поэтому исследования этой, до сегодняшнего времени, небольшой группы ферментов, представляют серьезный интерес.
Группа исследователей из ИТЭБ РАН под руководством д.б.н. Л.А.Железной одними из первых обнаружила никующую эндонуклеазу BspD6I, и первыми расшифровали ее пространственную структуру. Было установлено, что молекула фермента имеет доменную структуру и состоит из узнающего и каталитического доменов, соединенных между собой линкерным доменом.
Функцию белковой молекулы определяет ее активный центр – уникальная комбинация аминокислотных остатков в молекуле фермента с определенной ориентацией относительно друг друга. Для того, чтобы исследователи могли контролировать активность белка, важно знать роль отдельных аминокислот, входящих в активный центр фермента.
Исследователи из ИТЭБ РАН в молекуле никазы с помощью сайт-направленного мутагенеза заменили остаток глутаминовой кислоты E418 на аланин. Далее ими была получена высокоочищенная мутантная форма никазы, из которой был выращен белковый монокристалл. Методом рентгеноструктурного анализа была решена атомная структура молекулы мутантной никазы с разрешением 2.45 Å.
Сопоставление функции дикой и мутантной форм никазы показало, что изменение всего одной аминокислоты в структуре привело к серьезнейшим последствиям: резко снизилась способность фермента к связыванию с ДНК, и произошла полная потеря каталитической активности мутантного белка. Необходимо было найти объяснение причин, вызвавших изменение функциональных свойств мутантной никазы.
Старший научный сотрудник лаборатории клеточной инженерии ИТЭБ РАН, к.х.н. Римма Ивановна Артюх отмечает, рассказывая о результатах работы: «Сравнительный анализ кристаллических структур дикой и мутантной никаз показал, что удаление карбоксильной группы в Е418 инициирует заметные конформационные изменения, как в узнающем домене, отвечающем за связывание с ДНК, так и в каталитическом и незначительные - в линкерном домене. Сравнение электростатических потенциалов атомов аминокислотных остатков в активных центрах мутантной и дикой никаз показало заметные изменения электростатического поля в активном центре дикой никазы». Таким образом, увеличение доли отрицательных потенциалов в активном центре является барьером для взаимодействия никазы с отрицательно заряженной молекулой ДНК и приводит к потере способности фермента расщеплять цепь ДНК.
Источник: Artyukh, RI; Kachalova, GS; Yunusova, AK; Fatkhullin, BF; Atanasov, BP; Perevyazova, TA; Popov, AN; Gabdulkhakov, AG; Zheleznaya, LA. The key role of E418 carboxyl group in the formation of Nt.BspD6I nickase active site: Structural and functional properties of Nt.BspD6I E418A mutant. JOURNAL OF STRUCTURAL BIOLOGY, Том: 210 Выпуск: 3, DOI: 10.1016/j.jsb.2020.107508
http://apps.webofknowledge.com/full_record.do?product=WOS&search_mode=Ge