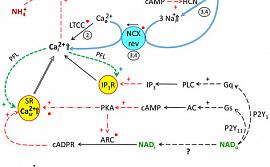
Ученые из Института теоретической и экспериментальной биофизики РАН и Института биофизики клетки РАН представили механистическую модель, описывающую взаимодействие каналов и вторичных мессенджеров, которая может выявить важную роль группы «спящих» каналов в регуляции сократительной активности папиллярных мышц сердца. Исследование актуально для разработки новых методов терапии ряда патологических состояний. Результаты работы опубликованы в высокорейтинговом журнале Membranes.
Сердечно-сосудистые заболевания являются основной причиной смерти во всем мире. Условием профилактики преждевременной смертности является обеспечение пациентам надлежащего лечения. В связи с этим научное сообщество ищет новые пути для решения этой проблемы.
Различные клеточные модели, в том числе, полученные из стволовых клеток из изолированных кардиомиоцитов с гиперэкспрессией или нокаутами каналов, используются для анализа функционального взаимодействия различных ионных токов, вовлеченных в регуляцию автоматизма сердца, генерации потенциала действия в «рабочем миокарде» и сопряжения электрического возбуждения и сокращения клеток миокарда.
Коллектив пущинских биофизиков для выявления взаимодействия нескольких ионных каналов, участвующих в регуляции сократительной способности папиллярных мышц сердца и изолированных кардиомиоцитов крыс, использовал известные гиперполяризующий (кофермент NAD) и деполяризующий (аммоний) агенты, с применением ингибиторного анализа, методов тензометрии (измерение силы сокращения при стимуляции) и электрофизиологии (пэтч-клямп).
Исследование прокомментировал ведущий научный сотрудник Лаборатории энергетики биологических систем ИТЭБ РАН, кандидат физико-математических наук Владимир Дынник: «Комплексное исследование взаимодействия сердечных ионных каналов важно, поскольку часть исследуемых каналов считается «спящими», т.е. имеет крайне низкую активность в клетках рабочего миокарда (например, в желудочках) и может активироваться в патологических условиях, в частности при гипертрофии миокарда, ремоделировании и аритмии. Используя модификаторы поляризации кардиомиоцитов (влияние на потенциал покоя и потенциал действия), а также ингибиторы ионных каналов и сигнальных систем вторичных мессенджеров, мы выявили важную роль внеклеточных ионов калия в регуляции и взаимодействии Kir2.x и HCN каналов, позволяющую определить функционирующие в системе обратные связи, необходимые для активации всей цепи каналов, вовлеченных в проведение возбуждения при некоторых типах патологий.
В дальнейшем авторы планируют проведение исследований по выявлению роли вторичных мессенджеров (с участием cAMP/PKA и cGMP/PKG) в регуляции этих каналов на моделях контрольного и гипертрофированного миокарда крыс.
Источник: Averin Alexey S., Konakov Maxim V., Pimenov Oleg Y., Galimova Miliausha H., Berezhnov Alexey V., Nenov Miroslav N., and Dynnik Vladimir V. Regulation of Papillary Muscle Contractility by NAD and Ammonia Interplay: Contribution of Ion Channels and Exchangers. Membranes 2022, 12(12), 1239; https://doi.org/10.3390/membranes12121239
Материал подготовила: Алсу Дюкина
Пресс-служба ИТЭБ РАН, iteb-press@yandex.ru
Рисунок. Кинетическая модель, описывающая вовлечение ионных каналов и вторичных мессенджеров, участвующие в контроле сокращения папиллярных мышц крыс при антагонизме НАД и иона аммония.