В совместной работе сотрудника Института теоретической и экспериментальной биофизики РАН и ученых из Института биоорганической химии РАН, Сколтеха, Первого медицинского института им. Сеченова, ФНКЦ физико-химической медицины, Московского физико-технического института, Рокасоланского института физики и химии (Испания) и Массачусетского технологического института (США) был разработан и охарактеризован новый функциональный аналог тимина – оксо-этеноаденин. Обнаруженные свойства этого нуклеотидного аналога могут найти применение в разработке молекулярных инструментов и терапевтических средств на основе нуклеиновых кислот. Работа опубликована в апрельском номере журнала Nucleic Acids Research.
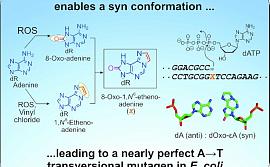
Оксо-этеноаденин представляет собой синтетический нуклеотид, объединивший в себе структурные элементы двух природных модификаций аденина: 8-оксоаденина и 1,6-этеноаденина. Обе модификации образуются в ДНК под воздействием окислительного стресса: 8-оксо группа присоединяется к аденину при прямом действии активных форм кислорода, а 1,6-этено группа формируется при взаимодействии аденина с окисленными липидами клеточных мембран.
Результаты исследования прокомментировала автор статьи, научный сотрудник Массачусетского технологического института и ИТЭБ РАН, кандидат биологических наук Нина Губина: «Оказалось, что оксо-этеноаденин не распознается бактериальными системами репарации ДНК, не вызывает остановку репликации ДНК и является крайне мутагенным: в 97% случаев оксо-этеноаденин мутировал в тимин не только в линиях с “выключенными” ферментами репарации ДНК, но и во всех контрольных линиях бактерий. Иными словами, ДНК-полимераза не считает этот нуклеотид ошибкой кода, а принимает его за тимин, и встраивает напротив него аденин в растущую цепь. Эффективность репарации поврежденного нуклеотида может зависеть от того, какие нуклеотиды находятся непосредственно слева и справа от него, однако оксо-этеноаденин был одинаково мутагенным во всех возможным тринуклеотидных окружениях. Для сравнения, 1,6-этеноаденин не является мутагенным в бактериях, обладающих полным набором ферментов репарации, и вызывает мутации всего в 30% случаев в клетках, лишенных основного фермента, ликвидирующего этот тип повреждений».
Исследование структуры оксо-этеноаденина показало, что спаривание этого нуклеотида с аденином происходит из-за нетрадиционного расположения азотистого основания оксо-этеноаденина над сахарным остовом ДНК, в результате чего образуется относительно прочная связь между нормальным аденином и 8-оксо- и 1,6-этено группами оксо-этеноаденина. Оксо-этеноаденин на удивление гармонично встраивается в двойную спираль ДНК и не вызывает возмущений ее структуры.
Возникновение подобных нерепарируемых повреждений в живой клетке приводило бы к накоплению мутаций и к гибели клетки. Однако для целей биотехнологии подобный нуклеотид может быть весьма полезным. Оксо-этеноаденин благодаря оксо- и этено- модификациям обладает флуоресцентными свойствами и может связываться с ионами металлов. Эти модификации не репарируются системами клетки, что обеспечивает оксо-этеноаденину стабильность в живых организмах и позволяет использовать его в составе флуоресцентных зондов, в качестве элемента молекулярных сенсоров нового поколения и для создания стабильных аптамеров – конструкций на основе ДНК, которые являются функциональными аналогами белковых антител и используются для распознавания различных мишеней на уровне молекул.
Материал подготовила: Алсу Дюкина
Пресс-служба ИТЭБ РАН, iteb-press@yandex.ru
Источник: Andrey V Aralov, Nina Gubina, Cristina Cabrero, Vladimir B Tsvetkov, Anton V Turaev, Bogdan I Fedeles, Robert G Croy, Ekaterina A Isaakova, Denis Melnik, Svetlana Dukova,
Dmitriy Y Ryazantsev, Alexei A Khrulev, Anna M Varizhuk, Carlos González, Timofei S Zatsepin, John M Essigmann. 7,8-Dihydro-8-oxo-1,N6-ethenoadenine: an exclusively Hoogsteen-paired thymine mimic in DNA that induces A→T transversions in Escherichia coli. Nucleic Acids Research, Volume 50, Issue 6, 8 April 2022, Pages 3056–3069, https://doi.org/10.1093/nar/gkac148
Подписи к рисункам:
1. Схема разработки ДНК модификации - оксо-этеноаденина, сочетающее в себе структурные особенности двух природных повреждений ДНК (7,8-дигидро-8-оксоаденин и 1,N6-этеноаденин).
2. Н.с. Лаборатории радиационной молекулярной биологии к.б.н. Нина Губина со структурой оксо-этеноаденина
Оксо-этеноаденин представляет собой синтетический нуклеотид, объединивший в себе структурные элементы двух природных модификаций аденина: 8-оксоаденина и 1,6-этеноаденина. Обе модификации образуются в ДНК под воздействием окислительного стресса: 8-оксо группа присоединяется к аденину при прямом действии активных форм кислорода, а 1,6-этено группа формируется при взаимодействии аденина с окисленными липидами клеточных мембран.
Результаты исследования прокомментировала автор статьи, научный сотрудник Массачусетского технологического института и ИТЭБ РАН, кандидат биологических наук Нина Губина: «Оказалось, что оксо-этеноаденин не распознается бактериальными системами репарации ДНК, не вызывает остановку репликации ДНК и является крайне мутагенным: в 97% случаев оксо-этеноаденин мутировал в тимин не только в линиях с “выключенными” ферментами репарации ДНК, но и во всех контрольных линиях бактерий. Иными словами, ДНК-полимераза не считает этот нуклеотид ошибкой кода, а принимает его за тимин, и встраивает напротив него аденин в растущую цепь. Эффективность репарации поврежденного нуклеотида может зависеть от того, какие нуклеотиды находятся непосредственно слева и справа от него, однако оксо-этеноаденин был одинаково мутагенным во всех возможным тринуклеотидных окружениях. Для сравнения, 1,6-этеноаденин не является мутагенным в бактериях, обладающих полным набором ферментов репарации, и вызывает мутации всего в 30% случаев в клетках, лишенных основного фермента, ликвидирующего этот тип повреждений».
Исследование структуры оксо-этеноаденина показало, что спаривание этого нуклеотида с аденином происходит из-за нетрадиционного расположения азотистого основания оксо-этеноаденина над сахарным остовом ДНК, в результате чего образуется относительно прочная связь между нормальным аденином и 8-оксо- и 1,6-этено группами оксо-этеноаденина. Оксо-этеноаденин на удивление гармонично встраивается в двойную спираль ДНК и не вызывает возмущений ее структуры.
Возникновение подобных нерепарируемых повреждений в живой клетке приводило бы к накоплению мутаций и к гибели клетки. Однако для целей биотехнологии подобный нуклеотид может быть весьма полезным. Оксо-этеноаденин благодаря оксо- и этено- модификациям обладает флуоресцентными свойствами и может связываться с ионами металлов. Эти модификации не репарируются системами клетки, что обеспечивает оксо-этеноаденину стабильность в живых организмах и позволяет использовать его в составе флуоресцентных зондов, в качестве элемента молекулярных сенсоров нового поколения и для создания стабильных аптамеров – конструкций на основе ДНК, которые являются функциональными аналогами белковых антител и используются для распознавания различных мишеней на уровне молекул.
Материал подготовила: Алсу Дюкина
Пресс-служба ИТЭБ РАН, iteb-press@yandex.ru
Источник: Andrey V Aralov, Nina Gubina, Cristina Cabrero, Vladimir B Tsvetkov, Anton V Turaev, Bogdan I Fedeles, Robert G Croy, Ekaterina A Isaakova, Denis Melnik, Svetlana Dukova,
Dmitriy Y Ryazantsev, Alexei A Khrulev, Anna M Varizhuk, Carlos González, Timofei S Zatsepin, John M Essigmann. 7,8-Dihydro-8-oxo-1,N6-ethenoadenine: an exclusively Hoogsteen-paired thymine mimic in DNA that induces A→T transversions in Escherichia coli. Nucleic Acids Research, Volume 50, Issue 6, 8 April 2022, Pages 3056–3069, https://doi.org/10.1093/nar/gkac148
Подписи к рисункам:
1. Схема разработки ДНК модификации - оксо-этеноаденина, сочетающее в себе структурные особенности двух природных повреждений ДНК (7,8-дигидро-8-оксоаденин и 1,N6-этеноаденин).
2. Н.с. Лаборатории радиационной молекулярной биологии к.б.н. Нина Губина со структурой оксо-этеноаденина